En la vida cotidiana, la materia que nos rodea se nos presenta en sus tres diferentes fases: la líquida, la sólida y la gaseosa. También es conocido por muchos de nosotros los cambios que pueden presentarse entre ellas, por ejemplo solidificar un líquido, derretir un sólido, etc. Todos estos cambios parecen sugerir que de no existir un agente externo que los provoque, la materia se encontraría en una sola fase. Normalmente, si queremos evaporar un líquido hay que calentarlo, a un gas comprimirlo para licuarlo, a un líquido enfriarlo para solidificarlo.
Pero surgen varias preguntas: ¿Por qué ocurren tales fenómenos?, ¿Cuáles son las propiedades de cada una de estas fases en términos de las partículas o entes que constituyen a la materia?. Pues bien a continuación daremos respuesta a dichas cuestiones.
En la antigüedad filósofos griegos hicieron una hipótesis en la cual mencionaban que la materia esta formada por partículas pequeñas indivisibles a las cuales denominaron átomos. En la actualidad dicha hipótesis ha sido plenamente confirmada y hay prueba s de que la materia que nos rodea aparte de estar constituida por átomos hay familias de estos llamadas moléculas.
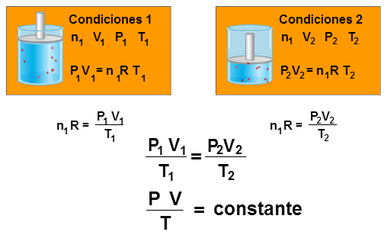
Cuando examinamos el comportamiento de una muestra de la materia, normalmente nos referimos a una cantidad de ella formada o constituida por un número enorme de átomos o moléculas. Por tanto, se hace necesario establecer relaciones entre las propiedades de un sistema, sea sólido, líquido o sólido con la presión, la temperatura, la densidad y otros atributos accesibles a nuestros sentidos. Una de las ramas de la fisicoquímica contemporánea que se ocupa de este estudio es la llamada teoría cinética de la materia.
A continuación analizaremos un poco más acerca de dicha teoría.

.jpg)



.jpg)